RADIOTERAPIA ESTEREOTÁXICA ABLATIVA (SABR) EM LESÕES INICIAIS DE PULMÃO NÃO PEQUENAS CÉLULAS
Marcus Simões Castilho*, Leonardo Furbino Pimentel*, Frederico Lins e Silva**, Miguel Torres Teixeira Leite*
* Radiocare - Centro Avançado de Radioterapia, Hospital Felício Rocho, Belo Horizonte, MG, Brasil.
**Departamento de Cirurgia Torácica, Hospital Felício Rocho, Belo Horizonte, MG, Brasil
Fevereiro de 2016
Introdução
O câncer de pulmão é a neoplasia mais diagnosticada e a mais importante causa de morte, por neoplasia, em todo o mundo. Apresenta uma incidência de 1,82 milhões de casos novos a cada ano, acometendo 1,24 milhões de homens e 583 mil mulheres.
No Brasil, é o segundo tumor mais frequente nas regiões sul e centro-oeste e o terceiro na região sudeste, acometendo cerca de 28.000 brasileiros a cada ano. (INCA 2014)
O tratamento de escolha para os tumores iniciais de pulmão, não pequenas células (NSCLC), é a lobectomia com abordagem linfonodal. Estima-se, contudo, que 25% destes pacientes são considerados clinicamente ou funcionalmente não passíveis de cirurgia, ou que recusam o procedimento cirúrgico (ABREU CECV et alii, 2015). Outro percentual de pacientes, porém, tem capacidade funcional limítrofe para cirurgia e apresenta alto risco de morbimortalidade cirúrgica, sendo, portanto, tais pacientes candidatos a outras técnicas que não a lobectomia.
Tradicionalmente estes pacientes, mesmo em estádios iniciais, são submetidos à radioterapia convencional fracionada durante seis semanas com sobrevida mediana de 6 a 18 meses e taxas de sobrevida global a cinco anos de apenas 15% (WISNIVESKY JP et alii, 2005).
Na década passada a Radioterapia Estereotáxica Ablativa (SABR, também chamada de radioterapia estereotáxica corpórea) demonstrou taxas de controle local acima de 90% em NSCLC estádio I em pacientes inoperáveis e operáveis ( ONISHI H et alii, 2004; SHIRVANI SM et alii, 2014).
Atualmente a SABR é considerada a primeira opção de tratamento, para pacientes clinicamente inoperáveis m NSCLC estádios iniciais.(SENAN S., et ali, 2014). Além disso, é alternativa a ser considerada em pacientes de alto risco cirúrgico, candidatos, por isso, a técnicas alternativas como a cirurgia sub-lobar.
Apesar de os principais consensos internacionais, como o NCCN (National Comprehensive Cancer Network), recomendarem fortemente a adoção dessa técnica esta abordagem tem sua expansão limitada pela complexidade tecnológica e conhecimento especializado.(NCCN.ORG). Este estudo sumariza as mais frequentes indicações, resultados, toxicidade, qualidade de vida, custo efetividade e, finalmente, os aspectos técnicos empregados em nossa Instituição.
Em Minas Gerais, no ano de 2014, foram realizados 1.240 diagnósticos de câncer de pulmão, com 20% em estádio I e II. Destes 20%, 89 casos representam pacientes clinicamente inoperáveis. Serão esses os candidatos à RT estereotáxica de pulmão (INCA, 2014).
Descrição
A sigla SABR, originária de língua inglesa (Stereotactic Ablative Body Radiotherapy) , se refere a uma técnica de radioterapia que emprega alta dose de radiação em um curto período de tempo (1 a 5 dias de tratamento).
Esta abordagem aumenta a efetividade biológica da dose (BED) com baixas taxas de complicação. Estudos radiobiológicos demonstram matematicamente que, em animais de experimentação, o emprego de altas doses aumenta os danos à célula tumoral e impede a repopulação neoplásica, um dos fenômenos mais importantes relacionados a recidiva local.(ZENG J., et alii, 2014)
Outra possibilidade de efeito é a de destruição neoplásica por exposição a antígenos tumorais e aumento da resposta imune aos possíveis focos subclínicos da doença (efeito abscopal).
SABR é uma terapia alternativa atraente por várias razões: é ambulatorial, não-invasiva, de curta duração (1 semana), geralmente sem sedação ou anestesia, permitindo o retorno imediato do paciente às atividades cotidianas.
A maioria dos estudos mostra uma pequena taxa de mortalidade, associada ao tratamento, 30 e 90 dias após o procedimento (ONISHI H. et alii, 2004; SHIRVANI SM et alii, 2014).
Indicações de SABR
A Tabela 1 lista as indicações de SABR em tumores iniciais de pulmão fora de protocolos clínicos.
Radiobiologia e SABR
O desafio da radioterapia tem sido o de tratar lesões neoplásicas com a máxima dose possível, com a preocupação permanente de poupar os tecidos sadios. Tenta-se alcançar tal objetivo através do emprego de doses fracionadas de 5 a 6 semanas.
A utilização de altas doses em poucas frações representa uma revolução no emprego da radioterapia para determinados tumores e pode ser considerada grande mudança neste paradigma nos últimos 90 anos. Os avanços tecnológicos permitem a administração de doses com margens reduzidas, rápido decréscimo fora do volume planejado, o que minimiza a exposição dos tecidos normais adjacentes.
Há grande controvérsia entre os radiobiologistas que discutem se as explicações clássicas que regem os fenômenos de radiosensibilidade (Rs) seriam capazes de explicar tal ação biológica, ou se um novo modelo deveria ser criado. Discute-se, também, se a efetividade do modelo linear quadrático descreveria de forma adequada a resposta às doses muito altas. (BROWN JM et al, 2014; HEONJOO P et alii)
A radiação interage com a matéria, e provoca ionização dos tecidos formando radicais livres que causam dano ao DNA, direta ou indiretamente, dano de difícil reparação e que pode ser classificado como dano subletal ou potencialmente letal. Em condições normais os danos subletais são completamente reparados dentro de horas. Quando os mecanismos de reparo do DNA deixam de atuar ocorre instabilidade cromossômica e as células sofrem morte pós-mitótica, enquanto as células normais sofrem apoptose após irradiação.
O emprego de altas doses não somente causa dano ao DNA mas também inflamação das células endoteliais e uma cascata de apoptoses, com grande disfunção microvascular levando à substituição por fibroblastos e à morte do tumor (modelo de dois alvos).
A apoptose nas células endoteliais é mediada pela via da esfingomielina, um lipídeo complexo, muito abundante na membrana das células e na bainha de mielina. Após a exposição à radiação em doses elevadas, a enzima esfingomielinase ácida (ASMase) é translocada para a membrana plasmática das células endoteliais, gerando ceramida. Esta promove indução a apoptose por ativação da proteína BAX apoptótica que leva à liberação de citocromo c mitocondrial que culmina na apoptose celular. Tais fenômenos interrompem a perfusão do tumor, ocorrendo com doses em torno de 10 Gy.(PETTUS BJ et alii )
Com o emprego de altas doses, a histologia do tumor, em desacordo com a radiobiologia clássica, não parece ser um fator preditivo de controle local. Portanto, na irradiação convencional o principal mecanismo de morte celular é o dano ao DNA, através da ionização. Na SABR o principal fenômeno indutor da morte celular é a indução a apoptose via geração de ceramida com dano endotelial, secundado pelos danos ao DNA.
Os acentuados fenômenos hipóxicos, gerados por alta dose, afetariam a reoxigenação e a reparação e atuariam sobre a redistribuição, fixando as células a uma determinada fase do ciclo levando a morte celular. Sendo um tratamento realizado em curto espaço de tempo, evitaria os fenômenos de repopulação.
Resultados do Tratamento
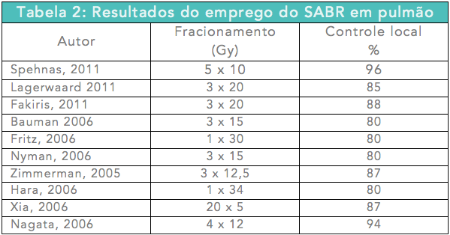
Os resultados do seguimento de pacientes ao longo de 3 anos mostram taxas de controle local acima de 80%. Alguns estudos demonstram taxas de impressionantes 94% ou mais. As taxas de sobrevida global foram bastante satisfatórias, com resultados girando em torno de 57%, em vista da idade avançada e o perfil de comorbidade da população estudada.(Tabela 2)
Uma análise retrospectiva de 2.226 pacientes em 20 instituições japonesas, publicada por Onishi H et AL, mostra que, do total de pacientes, 1.601 foram estadiados como IA e 625 como estadio IB. O seguimento mediano foi de 32 meses. Dos pacientes operáveis, a sobrevida global foi de 72%; a sobrevida livre de doença de 85%. O controle local foi de 87% em lesões T1 e de 72% em lesões T2. As complicações pulmonares grau ≥ 3 foram relatadas em 2,9% dos pacientes.
A Tabela 2 descreve séries selecionadas que mostram os diferentes fracionamentos empregados e o controle local aos 3 anos.
Análise interina dos resultados de dois estudos prospectivos de pacientes operáveis selecionados aleatoriamente, STARS e ROSEL, foram publicados. Ambos fechados prematuramente por baixo recrutamento, não atingiram o número de pacientes necessário para conclusões objetivas, portanto, devem ser avaliados com cautela. Pacientes com tumores de pulmão, estádio I, ressecáveis, foram randomizados para SABR (n=31) versus lobectomia (n=27). O seguimento médio foi de 40,2 meses no grupo SABR e de 35,4 meses no grupo lobectomia. Houve diferença estatisticamente significativa em sobrevida global, favorável ao grupo que recebeu SABR (log rank p=0,037; HR=0,14). O autor conclui que SABR representa uma opção a ser considerada no tratamento do câncer de pulmão de células não pequenas, estádio I, operáveis (CHANG JY et alii).
Aspectos Técnicos
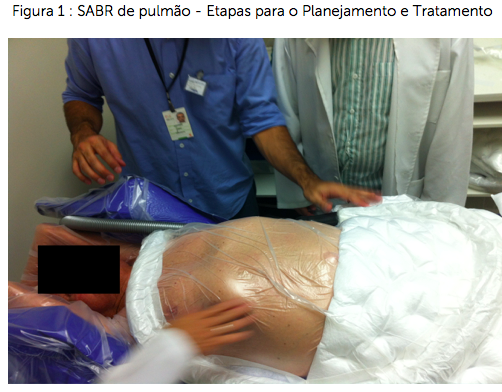
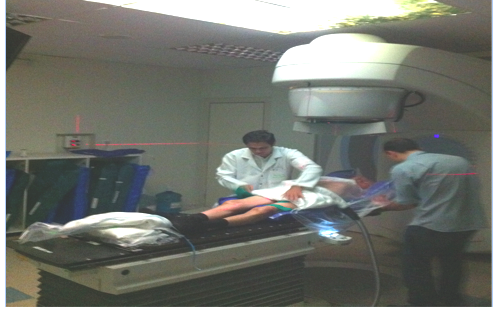
As diversas etapas, sumarizadas na Figura 1, são necessárias para a efetiva administração da dose. Resumidamente, envolvem a confecção de um sistema de imobilização personalizadoacoplado à caixa de localização estereotáxica. São realizadas seis aquisições tomográficas em livre respiração com contraste venoso. Delineia-se os ITVs (internal target volumes) em cada corte tomográfico com posterior fusão de todas as imagens. Em seguida, é feito o planejamento computadorizado utilizando-se o algoritmo de Montecarlo do software Monaco 5 da Elekta AB®. Empregam-se múltiplos campos estáticos não coplanares ou, através de VMAT (Volumetric Modulated Arc Therapy). Antes da tomografia computadorizada de planejamento e de cada aplicação o paciente é orientado a evitar os extremos do ciclo respiratório (breath coaching). O radiooncologista acompanha cada aplicação e aprova a verificação de imagem em todos os tratamentos. A administração leva de 4 a 8 minutos.
Imobilização - Confecção dee sistema de imobilização personalizado
Aquisição de imagem - Retificação da mesa e acoplamento do paciente no sistema de imobilização e caixa de localização estereotáxica. São realizadas de cinco a seis aquisições após treinamento de respiração (breath coaching).
Planejamento - Software de planejamento com correção de heterogeneidade e Método de Monte Carlo. As doses prescritas variam com a localização, tamanho e volume das lesões. O objetivo é que o BED seja maior que 100Gy. (Nagata, Y et alii, 2010)
Tratamento - Verificação prévia de cada aplicação pelo dosimetrista, físico e radiooncologista através de caixa localizadora e imagens de reconstruçãTratamento - Verificação prévia de cada aplicação pelo dosimetrista, físico e radiooncologista através de caixa localizadora e imagens de reconstrução digital, imagens portal eletrönicas e fiduciaiso digital, imagens portal eletrönicas e fiduciais
A dose de radiação a ser empregada está relacionada com a localização da lesão primária sendo de 3 frações de 18-20 Gy para lesões periféricas, de 5 frações de 10 Gy para lesões próximas a parede torácica ou centrais e de 8 frações de 7,5 Gy para lesões volumosas e/ou centrais.
Importante etapa do planejamento, para que se evitem efeitos colaterais, está na cuidadosa delimitação dos órgãos de risco, pele, pulmão, coração, árvore brônquica, esôfago, parede torácica, medula espinhal e na determinação das doses máximas que estas áreas podem receber. As restrições de dose estão listadas na Tabela 3 e derivam das recomendações do RTOG 0236. (TAREMI M et ali,2012)
* Estas e as demais não descritas restrições de doses são baseadas nos estudos do RTOG 0618,0813,091
Toxicidade - Qualidade de Vida
A pneumonite por radiação (PR) é o efeito mais comum da toxicidade após SABR. A maior parte da PR é assintomática ou de graus 1 ou 2. Uma incidência de complicação grau 3, densas alterações imaginológicas com severa fibrose pulmonar ou pneumonite; ou grau 4, severa insuficiência respiratória com uso contínuo de oxigênio e ventilação assistida é usualmente abaixo de 8%. (KANG KH et ali, 2015)
A SABR pode ser realizada em pacientes com comorbidades pulmonares graves e em doentes com a função pulmonar pré-tratamento muito limitada. Estudos retrospectivos analisaram testes de função pulmonar após SABR e concluíram não haver associação entre os valores pré-tratamento e a incidência de pneumonite grave em pacientes com doença obstrutiva crônica pulmonar severa.(STONE B., et alii, 2015; SWISHER SG., et alii, 2015). Provas de função pulmonar, como a espirometria, e provas de difusão, comprovam a segurança do método em pacientes clinicamente não operáveis. (STONE B. et alii, 2015)
O estudo RTOG 0236 corroborou não haver mudanças clinicamente significativas na função pulmonar com emprego de dose de 54 Gy em três frações.
Estudo que avaliou qualidade de vida após SABR mostrou que o tratamento é bem tolerado e não há decréscimo significativo na manutenção das atividades cotidianas.(SUN V. et alii, 2014)
Fraturas de costelas e neuralgia foram relatadas em alguns pacientes quando o tumor se encontra próximo da parede torácica. Toxicidade grave do plexo braquial (dor neuropática, fraqueza motora, sensorial ou alteração), dos grandes brônquios (estenose com atelectasia pulmonar) e esôfago (ulceração, perfuração, fístula) foram relatados, mas esses eventos são incomuns (Tabela 5).
Custo Efetividade
Três estudos abordaram especificamente a relação custo-efetividade da SABR e concluíram que a radioterapia extereotáxica de pulmão é o mais efetivo tratamento para lesões clinicamente inoperáveis de pulmão quando comparado com as abordagens terapêuticas convencionais. (SHER DJ et ali, 2011; SMITH BD et ali, 2015 )
Conclusão
A SABR é uma terapia eficaz e segura para pacientes com NSCLC clinicamente inoperáveis, para aqueles com função pulmonar limítrofe e com risco mais elevado de mortalidade cirúrgica (alternativa à ressecção sub-lobar) e para os pacientes que recusam cirurgia.
Quatro grandes protocolos internacionais em andamento RTOG 0915, RTOG 0813, Dutch Lung Cancer Research Group e o RTOG 0618 testam diferentes fracionamentos de dose em função da localização da lesão e trarão informações que podem auxiliar na otimização de parâmetros objetivando tornar a técnica ainda mais eficaz e segura.
Uma abordagem multidisciplinar deve ser implementada com o objetivo de determinar a melhor estratégia de tratamento em uma base individual. Apesar de parecer igualmente eficaz em pacientes operáveis, estudos prospectivos aleatorizados comparando SABR com cirurgia em paciente operáveis são desejados e aguardados.
Referências Bibliográficas
ABREU CECV; FERREIRA PPR; MORAES FY; NEVES Jr WFP; GADIA R; CARVALHO HA. Radioterapia estereotáxica extracraniana em câncer de pulmão: atualização Jornal Brasileiro de Pneumologia. Volume 41 Número 4 (Julho/Agosto), 2015.
BROWN JM, DAVID J. CARLSON DJ, BRENNER DJ. The Tumor Radiobiology of SRS and SBRT: Are More thanthe 5 R’sInvolved? Int J RadiatOncolBiolPhys. 2014 February 1; 88(2): 254–262.
CHANG JY, LIU H, BALTER P, et al. Clinical outcome and predictors of survival and pneumonitis after stereotactic ablative radiotherapy for stage I non-small cell lung câncer. Radiat Oncol, 10 (2012), p. 152
CHANG JY, SENAN S, PAUL MA, et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomised trials. Lancet Oncol 16: 630-7, 2015.
CRABTREE TD, DENLINGER CE, MEYERS BF, et al. Stereotactic body radiation therapy versus surgical resection for stage I non-small cell lung câncer. J Thorac Cardiovasc Surg, 140 (2010), pp. 377–386
HEONJOO PARK, ROBERT J. GRIFFIN, SUSANTA HUI, SEYMOUR H. LEVITT, and CHANG W. SONGChang. Radiation-Induced Vascular Damage in Tumors: Implications of Vascular Damage in Ablative Hypofractionated Radiotherapy. Radiation Research: March 2012, Vol. 177, No. 3, pp. 311-327.
http://www.nccn.org/professionals/physician_gls/pdf/scl.pdf
INCA - estimativa, 2014 – http://inca.gov.br/estimativa/2014.
KANG KH, OKOYE CC, PATEL RB, SIVA S, BISWAS T, ELLIS RJ, YAO M, MACHTAY M, Lo SS. Complications from Stereotactic Body Radiotherapy for Lung Cancer.Cancers (Basel).Jun 15;7(2):981-1004, 2015.
LAGERWAARD FJ, HAASBEEK CJ, SMIT EF, SLOTMAN BJ, SENAN S. Outcomes of risk-adapted fractionated stereotactic radiotherapy for stage I non-small-cell lung câncer. Int J Radiat Oncol Biol Phys, 70 (2008), pp. 685–692
LAGERWAARD FJ, VERSTEGEN NE, HAASBEEK CJ, et al. Outcomes of stereotactic ablative radiotherapy in patients with potentially operable stage I nonsmall cell lung câncer. Int J Radiat Oncol Biol Phys, 83 (2012), pp. 348–353
MITERA G. Cost-effectiveness analysis comparing conventional versus stereotactic bodyradiotherapy for surgically ineligible stage I non-small-cell lung cancer. J OncolPract;10 (3):e130-6, 2014.
NAGATA Y, HIRAOKA M, SHIBATA T, et al. A phase II trial of stereotactic body radiation therapy for operable TIN0M0 non-small cell lung cancer: Japan Clinical Oncology Group (JCOG0403). Int J Radiat Oncol Biol Phys, 78 (2010), p. S27 (abstr)
ONISHI H, ARAKI T, SHIRATO H, et al. Stereotactic hypofractionated high-dose irradiation for stage I nonsmall cell lung carcinoma: clinical outcomes in 245 subjects in a Japanese multiinstitutional study. Cancer, 101 (2004), pp. 1623–1631
ONISHI H, SHIRATO H, NAGATA Y, et al. Stereotactic body radiotherapy (SBRT) for operable stage I non-small-cell lung cancer: can SBRT be comparable to surgery? Int J Radiat Oncol Biol Phys, 81 (2011), pp. 1352–1358
PALMA D, VISSER O, LAGERWAARD FJ, BELDERBOS J, SLOTMAN B, SENAN S. Impact of introducing stereotactic lung radiotherapy for elderly patients with stage I non-small-cell lung cancer: a population-based time-trend analysis. J Clin Oncol, 28 (2010), pp. 5153–5159
PALMA D, VISSER O, LAGERWAARD FJ, BELDERBOS J, SLOTMAN B, SENAN S. Treatment of stage I NSCLC in elderly patients: a population-based matched-pair comparison of stereotactic radiotherapy versus surgery. Radiother Oncol, 101 (2011), pp. 240–244
PETTUS BJ, CHALFANT CE, HANNUN YA. Ceramide in apoptosis: an overview andcurrent perspectives. BiochimBiophys Acta. 2002 Dec 30;1585(2-3):114-25.
SENAN S, GUCKEMBERGER M, RICARDI U. Stage I non-small cell lung cancer and oligometastatic disease. In: Pass HI, Ball D, Scagliotti GV, editors. IASLC textbook multidisciplinary approach to thoracic oncology textbook. Aurora, CO: International Association for the study of Lung Cancer; 2014
SHER DJ, WEE JO, PUNGLIA RS. Cost-effectivenessanalysis of stereotacticbodyradiotherapy-andradiofrequencyablation for medicallyinoperable, early-stage non-small cell lungcancer. Int J RadiatOncolBiolPhys. 2011: 1;81(5):e767-74.
SHIRVANI SM, JIANG J, CHANG JY, et al. Lobectomy, sublobar resection, and stereotactic radiation for stage 1 non-small cell lung cancers in the elderly. JAMA Surg, 149 (2014), pp. 1244–1253
SMITH BD, JIANG J, CHANG JY, Welsh), LIKHACHEVA A, BUCHHOLZ Cost-effectiveness of stereotactic radiation, sublobar resection, and lobectomy or early non-small cell lung cancers in older adults. J GeriatrOncol. Jul;6(4):324-31, 2015.
STONE B, MANGONA VS, JOHNSON MD, YE H, GRILLS IS. Changes in Pulmonary Function Following Image Guided Stereotactic Lung Radiotherapy: Neither Lower Baseline or Post-SBRT Pulmonary Function are Associated with Worse Overall Survival. J ThoracOncol. 2015 Sep, 2015.
SUN V, KIM JY, WILLIAMS AC, RAZ DJ, SAMPATH S, FERRELL B. Quality of life and symptoms following stereotactic body radiotherapy in early-stage lung cancer patients. J Community Support Oncol. 2014 Nov;12(11):407-414.
SWISHER SG, SHIRVANI SM. Effect of stereotactic dosimetricend points on overall survival for Stage I non-small cell lung cancer: A critical review.Mulryan K, Leech M, Forde E.MedDosim. Winter; 40(4):340-6, 2015.
TAREMI M, HOPE A, DAHELE M, et al. Stereotactic body radiotherapy for medically inoperable lung cancer: prospective, single-center study of 108 consecutive patients. Int J Radiat Oncol Biol Phys, 82 (2012), pp. 967–973
TIMMERMAN RD, PAULUS R, GALVIN J, et al. Stereotactic body radiation therapy for inoperable early stage lung cancer. JAMA, 303 (2010), pp. 1070–1076
TIMMERMAN RD, PAULUS R, PASS HL, et al. RTOG 0618: Stereotactic body radiation therapy (SBRT) to treat operable early-stage lung cancer patients. Proc Am Soc Clin Oncol, 31 (suppl) (2013), p. S7523 (abstr)
VERSTEGEN NE, OOSTERHUIS JW, PALMA DA, et al. Stage I-II non-small-cell lung cancer treated using either stereotactic ablative radiotherapy (SABR) or lobectomy by video-assisted thoracoscopic surgery (VATS): outcomes of a propensity score-matched analysis. Ann Oncol, 24 (2013), pp. 1543–1548
WISNIVESKY JP, BONOMI M, HENSCHKE C, IANNUZZI M, MCGINN T. Radiation therapy for the treatment of unresected stage I-II non-small cell lung cancer. Chest. 2005;128:1461–1467.
ZENG J, BAIK C, BHATIA S, MAYR N, RENGAN R. Combination of stereotactic ablative body radiation with targeted therapies. Lancet Oncol. 2014 Sep;15(10):e 426-34.