NANOPARTÍCULAS DE OURO COMO
AGENTES POTENCIALIZADORES DA RADIOTERAPIA
Jony M. Geraldo (a,b,c,d), Kennedy B. Gonçalves (c) , Lídia M. Andrade (c), Clascídia A. Furtado (a) e Luiz O. Ladeira (c).
(a) Centro de Desenvolvimento da Tecnologia Nuclear – CDTN / CNEN, Belo Horizonte, MG, Brasil.
(b) Departamento de Anatomia e Imagem, Faculdade de Medicina, Universidade Federal de Minas Gerais, Belo Horizonte, MG, Brasil.
(c) NanoBioMedical Research Group, Laboratório de Nanomateriais, Departamento de Física, Universidade Federal de Minas Gerais, Belo Horizonte, MG, Brasil.
(d) Serviço de Radioterapia, Hospital Alberto Cavalcanti – FHEMIG, Belo Horizonte, MG, Brasil.
Outubro de 2016
Resumo
Nos últimos cinco anos tem crescido o número de trabalhos relativos ao uso de nanopartículas de ouro como radiosensibilizadores que potencializam os efeitos das radiações ionizantes em células cancerígenas. O objetivo é carregar os tumores com as nanopartículas de ouro, levando a uma dose de radiação mais elevada para o tecido canceroso em comparação com a dose recebida pelo tecido normal, melhorando desta forma os resultados da radioterapia. As nanopartículas de ouro podem ser utilizadas tanto na forma de nanoesferas quanto de nanobastões, ambas com síntese bem estabelecida. A escolha do ouro se deve a várias razões, principalmente devido à facilidade de funcionalização. Neste processo, reveste-se a superfície das nanopartículas com ligantes que desempenharão funções específicas após internalização celular. A eficácia desta modalidade de tratamento se deve à associação da radiação ionizante, nanopartículas de ouro e sua funcionalização. Apresenta-se aqui resultados das principais referências sobre a aplicação desta associação como terapia para o câncer e o advento de uma nova técnica de diagnóstico molecular, tumor específica, também utilizando nanoparticulas de ouro.
Palavras-chave: Radioterapia; nanopartículas de ouro; síntese e funcionalização; terapia e diagnóstico do câncer
Introdução
Uma melhora dos resultados terapêuticos da Radioterapia tem sido investigada em estudos in vitro, por meio da associação da radiação ionizante com nanopartículas de ouro (AuNP) introduzidas no interior de células cancerígenas. As AuNP fornecem uma plataforma química flexível para incorporação de vários esquemas para localizar a dose no tumor devido à possibilidade de se produzir propriedades funcionais desejáveis. Combinado com os avanços tecnológicos na instrumentação utilizada para gerar radiação ionizante, o emprego de AuNP produz um aumento significativo da dose específica no tumor.
A escolha do ouro como agente radiosensibilizador se deve à várias razões, dentre as quais se destacam:
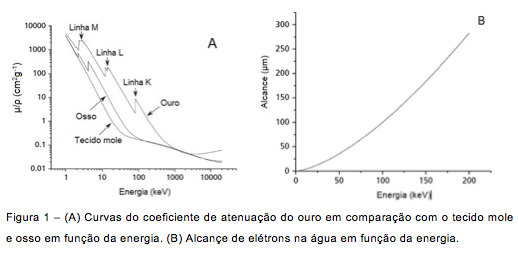
(1) – Sua elevada densidade específica gera uma alta absorção e atenuação da radiação em várias fáixas de energia quando comparado ao meio biológico como mostra a figura 1A;
(2) – A linha k-α do ouro apresenta um efeito de absorção ressonante de radiação próxima dos 80keV com emissão de uma cascata de elétrons Auger de baixa energia, úteis para dar uma dose localizada. O alcance de elétrons com energia entre 5 e 80keV está na faixa entre 4 e 70μm como mostra a figura 1B. Portanto, estes elétrons contribuem para a dose local em torno das AuNPs;
(3) – Já foi mostrado que o ouro apresenta baixa citotoxidade, fácil internalização na célula, sendo excretado pelas vias usuais;
(4) - Por apresentar muitos elétrons livres, várias moléculas podem ser adsorvidas em sua superfície, apresentando também boa afinidade para se ligar a móleculas do grupo tiol (enxofre-hidrogênio);
(5) – Em um processo conhecido como funcionalização, pode-se incorporar em sua superfície vários ligantes tais como proteínas, anticorpos e trechos de DNA, podendo transportar estas estruturas para o interior das células e impor às AuNP uma função específica dentro da célula.
O objetivo é carregar os tumores com AuNP, levando a uma dose mais elevada para o tecido canceroso em comparação com a dose recebida pelo tecido normal durante um tratamento por radioterapia. A radiossensibilização por AuNP representa uma nova abordagem para melhorar a eficácia da radiação ionizante, representando uma abordagem promissora para o tratamento do câncer por radioterapia.
Síntese de nanopartículas de ouro
A primeira síntese relatada de nanopartículas de ouro coloidal data de 1857, quando Michael Faraday reduziu cloreto de ouro por fósforo e estabilizou por dissulfeto de carbono, resultando em solução vermelha. Hoje em dia, as sínteses de nanopartículas de ouro ainda se baseiam na reação de Faraday, pela qual um sal de ouro é quimicamente ou eletroquimicamente reduzido na presença de ligantes que impedem a agregação das partículas por meio de repulsão eletrostática e/ou física (VERSIANI AF, et alii.. 2016).
As formas mais comumentemente utilizadas são as nanopartículas esféricas e os nanobastões de ouro. As rotas de síntese para as duas formas apresentam algumas diferenças. Nanoesferas são mais simples e necessitam de um redutor, normalmente citrato de sódio e ácido cloroauríco (HAuCl4) diluídos em água. Já nanobastões de ouro necessitam de um surfactante e um estabilizante. Atualmente, um dos protocolos mais populares é a síntese por semente que consiste na utilização de um agente redutor fraco, normalmente ácido ascórbico, brometo de cetiltrimetilamônio, (CTAB) como surfactante, nitrato de prata e boro-hidreto de sódio, um redutor forte que controla o tamanho das AuNPs. CTAB é propenso a formar uma estrutura micelar, como forma cilíndrica sobre a superfície axial da nanopartícula crescente, forçando o crescimento dos seus eixos2. Outros métodos físicos, tais como a fotoquímica, Sonochemistry, radiólise e termólise têm sido utilizados com sucesso para melhorar a qualidade das AuNPs, dando origem a diferentes formas com tamanhos estritamente controlados (VERSIANI AF, et alii.. 2016; CHEN H, et alii 2013).
Métodos de funcionalização de nanopartículas de ouro
Para atingir o sítio de interesse e promover interações eficientes, as AuNPs requerem modificações complexas em suas superfícies, conhecidas como funcionalização. Este processo consiste de um revestimento da superfície das AuNPs com uma ou mais biomoléculas, incluindo DNA/RNA, oligonucleotídeos, peptídeos, anticorpos, corantes fluorescentes, polímeros, drogas, marcadores tumorais, enzimas e outras proteínas. Em última análise, a estratégia de conjugação é diretamente dependente de um número de fatores tais como o tamanho da partícula, sua química de superfície, bem como o tipo de ligantes e grupos funcionais adicionados ao sistema (VERSIANI AF. et alii 2016).
A estratégia de funcionalização a ser utilizada deve basear-se nas características das AuNPs, o processo de síntese, a substância utilizada como um estabilizador e as características das moléculas a serem conjugadas. Nanobastões de ouro podem ser sintetizados com uma ou duas camadas do surfactante, que atuam quer como agentes estabilizantes para evitar a agregação ou, em alguns casos, como um agente de forma guiando o crescimento das AuNPs. Nesses casos, tais camadas podem ser usadas como agentes de funcionalização.
Muitas moléculas orgânicas têm terminações tiol livres ou podem ser manipuladas para apresentá-los. Os tióis apresentam uma afinidade química natural para superfícies de ouro, sendo a base para a funcionalização das AuNPs de acordo1. Biomoléculas, drogas, ácidos nucléicos que possuam resíduos de tiol podem ser prontamente fixados na superfície de nanoparticulas de ouro através da formação de ligações de Au-S.
Quando as moléculas de interesse não apresentam residuos de tiol a estratégia é usar um ligante que irá introduzir o biofuncionalizante necessário e que permita esta funcionalização. Os ligantes mais usados são polietileno glicol (PEG) tiolado e EDC/NHS. Estes ligantes facilitam a ligação de grupos funcionais carboxila e amina, presentes na maioria das biomoléculas. Outras formas de interção ocorrem por ligações covalentes, ponto isoelétrico ou conjugação eletrostática (VERSIANI AF. et alii, 2016).
Fator de crescimento da dose em função da energia dos fótons
Para avaliar o crescimento na dose local devido à presença de AuNP é útil definir o Fator de Crescimento da Dose (FCD) como sendo a razão da dose (DAu) em um ponto no interior de uma solução aquosa na presença de AuNP e a dose no mesmo ponto sem AuNP (CHO SH, 2005; BERBECO R, et al ), ou seja:
Os cálculos indicam que este aumento da dose pode ser significativo, entre 2 e 200 ou até mesmo chegar próximo a 1000. Os parâmetros físicos, químicos e biológicos que afetam este crescimento da dose têm sido discutidos amplamente.
As AuNP têm demonstrado eficácia terapêutica em ensaios com animais e os resultados mostram que, com uma injecção intravenosa de AUNP antes da irradiação com fótons de 250kVp, houve cura de 86% a longo prazo (> 1 ano) de camundongos EMT-6 com tumores subcutâneos mamários, enquanto que apenas 20% foram curados com a radiação sozinha (HAINFELD J.F. et al). Foi apontado que os fótons de baixa energia são melhores para induzir a liberação secundária da dose em AuNP, quando comparado com feixes de megavoltagem (HAINFELD J.F. et al 2008; MESBAHI A. et al, 2013).
De modo controverso, alguns estudos mostram que um alto FCD pode ser observado mesmo em feixes de raios X de megavoltagem (BERBECO R.I.. et al 2011; McMAHON S.J. et al 2011; JAIN S. et al 2011). Uma vez que elétrons de baixa energia são criados em grande número por qualquer tipo de radiação ionizante, as propriedades radiosensíveis das AuNP ocorrem para qualquer tipo de radiação de alta energia, incluindo os feixes de fótons de 1-18 MeV comumentemente usados em radioterapia (ZHENG I. et al 2008). As AuNP podem levar a um aumento dramático na dose em nanoescala nas imediações das nanopartículas e um modelo de efeito local foi proposto (BERBECO R.E. et al 2011). Este modelo sugere que mesmo em energias na faixa de megavoltagem as AuNP podem contribuir significativamente com um aumento na dose local.
O FCD varia bastante conforme a energia dos fótons incidentes, tamanho das AuNP, concentração e localização intracelular. Um estudo de dosimetria de uma única célula foi usado para estimar o aumento da dose para as células endoteliais ligando as AuNP às paredes dos vasos sanguíneos do tumor durante a irradiação com feixes de fótons de 6MeV (McMAHON S. J. et al, 2011). O FCD observado é atribuído aos foto-elétrons de baixa energia e curto alcance produzidos durante a radioterapia externa, aumentando a dose local. Esse estudo mostra que, dependendo da concentração de AuNP, o FCD pode atingir valores tão altos como 4,4 (aumento da dose de 340%) evidenciando que um importante aumento da dose local na microvasculatura tumoral é possível a partir da irradiação com raios-X convencionais produzidos por um acelerador linear.
Alvos celulares e nanopartículas de ouro
como tratamento adjuvante à braquiterapia
Devido ao alto FCD observado no intervalo de baixa energia, muitos modelos de braquiterapia foram propostos (CHO S.H. et al, 2009). O FCD de tumor pode mesmo ser personalizado variando os tamanhos e concentração das AuNP introduzidas nas células e o tipo de fonte de braquiterapia empregada, conduzindo a uma nova aplicação potencial de braquiterapia com possibilidade de desenho da dose in situ (SINHA N. S. et al, 2015; NGWA W. et al, 2010).
Não só o DNA tem sido proposto como alvo na célula (ZHENG, I. et al 2011), mas também estruturas, tais como mitocôndrias (KRKBY, C. et alii 2015) e células endoteliais vasculares (McMAHON, S. J. et al; NGWA W. et al 2010). Na presença de AuNP os danos da radiação em mitocôndrias tem mostrado alteração nos processos celulares, podendo levar a célula à apoptose. As AuNP podem melhorar esses efeitos quando são agregadas nas membranas exteriores das mitocôndrias, e apesar do fato de que um baixo FCD foi obtido, a mitocôndria tem sido proposto como um alvo potencial para a terapia de radiação em vez do DNA nuclear (KRKBY, C. et alii 2015)).
Tomando o DNA como um alvo para captação de AuNP, a associação com radiação ionizante mostra que os danos podem aumentar uma ordem de grandeza utilizando elétrons de baixa energia na faixa de 8 a 68eV (AHENG, I. et al 2008). Os resultados sugerem que o aumento da radiossensibilidade é devido à produção adicional de elétrons secundários de baixa energia causados pelo aumento da absorção de energia da radiação ionizante pelas AuNP. Salienta-se que a energia dos elétrons deve ser escolhida de modo que o livre caminho médio varie de 0,8 a 2,5 nm, que é essencialmente o diâmetro do ADN (CAI, Z. et al 2006). O aumento da produção de elétrons de baixa energia perto do DNA, induzido pela presença de AuNP durante a irradiação, parece ser um mecanismo plausível para explicar o aumento observado experimentalmente em danos no DNA. Mesmo elétrons com energias abaixo de 15 eV podem eficientemente induzir quebras simples (SSB) e duplas (DSB) cerca de três vezes mais eficiente por quantidade de energia absorvida do que os raios X de alta energia (CAI, Z. et al 2005).
Agentes destruidores da vascularização tumoral (ADVT) representam uma abordagem promissora para o tratamento do câncer, tendo em vista o papel fundamental da vascularização na sobrevivência, crescimento e metástase tumoral. Os ADVTs têm como alvo as células endoteliais dismórficas do tumor, podendo causar oclusão seletiva e rápida da vasculatura tumoral, levando as células tumorais à morte apartir de isquemia e necrose extensa hemorrágica. De modo geral os modelos dosimétricos para emprego das AuNP como ADVT adotam as considerações mostradas na figura 2.
O potencial para a aplicação de nanopartículas de ouro (AuNP) como ADVTs durante a braquiterapia foi também investigado (McMAHON, S. J. et al 2011; NGWA W. et al 2010). Utilizando simulação de Monte Carlo o FCD foi calculado para quatro diferentes fontes de braquiterapia, a saber, I-125, Pd-103, Yb-169 e raios X de 50 kVp, concentrações diferentes AuNP e várias espessuras de células endoteliais. Os resultados mostram que, mesmo em concentrações relativamente baixas de AuNP intra-vascular, doses ablativas para células endoteliais de tumor podem ser conseguidas e o melhor resultado foi obtido utilizando Pd-103, registrando valores de FCD de até 271,5 com a concentração mais elevada de AuNP e menor espessura das células endoteliais (NGWA W. et al 2010). Os autores sugerem que a aplicação direcionada de AuNP na vasculatura do tumor fornece um impulso significativo para analisar as AuNP como ADVT durante a braquiterapia, tal como um adjuvante ao tratamento, podendo-se alcançar elevados crescimentos da dose ablativa para as células endoteliais, mesmo utilizando fontes de energias mais baixas. Isso resultaria em um rápido dano biológico grave nas células endoteliais tumorais, sem aumento da toxicidade para o tecido saudável que não conten AuNP.
Estudos teóricos utilizando métodos de Monte Claro introduziram um modelo de microdosimetria em braquiterapia ao nível sub-celular para estimar o FCD associado a uso de AuNP e várias fontes de baixa taxa de dose (NGWA, W. et al 2012). Os resultados mostraram que o valor de FCD depende do tamanho do núcleo, do volume celular, da concentração de AuNP utilizada e apontam o Pd- 103 como o radioisótopo que produz os mais altos valores de FCD, atingindo picos de até 79,2. Em outro estudo utilizando também simulação de Monte Carlo e quase as mesmas fontes de braquiterapia observou-se um aumento de 103 na taxa de absorção fotoeléctrica utilizando 125I em comparação com 6 MV (LECHTMAN, E. 2011) na presença de AuNP. São sugeridas duas estratégias clínicas: a primeira utiliza fótons com energias abaixo da borda-k do ouro, tirando proveito da cascata de elétrons Auger extremamente localizada. Ela requer pequenas AuNP conjugadas com localizadores de alvos tumorais ou sequências de localizadores nucleares. O segundo, usando fontes de fótons com energias acima da borda da banda-K, requer uma concentração de ouro superior na região do tumor e, neste caso, a energia depositada por fotoelétrons é a principal contribuição para a radiossensibilização, em vez do tamanho e localização celular das AuNP (LECHTMAN, E. 2011).
Próton também tem sido investigado como uma radiação que colide com AuNP, a fim de obter um efeito de aumento de dose em terapia de radiação e o FCD calculado pode ser de até 14 (LIN, Y. et al 2014). O mecanismo pelo qual as AuNP podem levar ao aumento da dose absorvida difere quando se compara a radiação de fótons e de prótons. Os valores de FCD são independentes da energia dos prótons, enquanto é altamente dependente da energia dos fótons utilizados.
Emprego de nanopartículas de ouro no diagnóstico do câncer
A compreensão da dinâmica da difusão e os mecanismo de absorção das AuNP em células cancerosas é muito importante para a construção de nanossondas multifuncionais para localização seletiva nas células tumorais. As AuNP funcionalizadas podem ser eficazmente utilizadas como sondas fluorescentes para imaginologia e ainda mais importante para estudos de localização e de tráfico intracelular utilizando espectroscopia de correlação de fluorescência. Demonstrou-se que as nanopartículas de ouro conjugadas a Herceptin (H-AuNP) se agregam ao lisossoma e ao endossoma mas não com o complexo de Golgi, apresentando uma concentração 7,5 vezes maior no endossoma do que no lisossoma após internalização (CHEN, J. et al. 2009).
Conjugando marcadores tumorais específicos com as AuNP, pode-se obter uma cinética de distribuição desejada in vivo para realizar uma nova modalidade de imaginologia alvo específica ativada por uma única nanoplataforma (XIAO, M. et al 2010). Esta modalidade de imagem combina espectroscopia Raman de superfície (ERS) com tomografia computadorizada (TC), com as AuNP sendo utilizadas como sonda in vivo para produzir o maior sinal possível de ERS e como um agente de contraste de TC que produz uma atenuação da intensidade dos raios-X maior do que os agentes de contraste iodados normalmente utilizados. Esta modalidade de dupla imagem pode ser potencialmente utilizada para estudos do câncer, em que o tumor é localizado inicialmente por imagem de TC de corpo inteiro e, em seguida, na avaliação de ERS a nível molecular gera-se o perfil dos múltiplos marcadores tumorais afim de se obter um diagnóstico, estadiamento e tratamento específicos para cada paciente.
Conclusão e perspectivas futuras
A conjugação de radiação ionizante, nanopartículas de ouro e sua funcionalização mostra-se promissora no tratamento e diagnóstico do câncer. A maioria dos estudos se concentra em modelos teóricos, em especial com aproximação de Monte Carlo, carecendo de medidas dosimétricas absolutas das doses envolvidas e seus respectivos efeitos biológicos.
Recentemente, várias instituições dos Estados Unidos e do Canadá, tais como, o Departamento de Radioterapia do Hospital Geral de Massachusetts, a Escola de Medicina de Harvard, o Departamento de Física da Universidade de Ryerson em Toronto, o Departamento de Física das Radiações da Universidade do Texas e o Departamento de Radioterapia do Centro de Câncer MD Anderson em Houston no Texas, dentre outras, publicaram os passos que devem ser seguidos para avançar com as aplicações pré-clinicas das AuNPs em Radioterapia e posteriormente até mesmo o seu uso rotineiro ou eventual (JAN SCHUEMANN et al, 2016).
Acreditamos que esse possa ser o primeiro passo para tornar realidade os efeitos prometidos pelas nanopartículas de ouro, bem como dar uma maior sobrevida à radioterapia como técnica de tratamento do câncer, especialmente em tumores radiorresistentes.
Referências
BERBECO R, et al. In vitro dose enhancement from gold nanoparticles under different clinical MV photon beam configurations. Med Phys. 2012; 39;6:3900.
BERBECO R.I. et al. Localized dose enhancement to tumor blood vessel endothelial cells via megavoltage x-rays and targeted gold nanoparticles: new potential for external beam radiotherapy. Int. J. Radiation Oncology Biol. Phys. 2011 Oct; 81 (1): 270–276.
CAI Z. et al. Enhanced DNA damage induced by secondary electron emission from a tantalum surface exposed to soft X rays. Radiat. Res. 2006; 165: 365–371.
CAI Z. et al. Comparison between X-ray photon and secondary electron damage to DNA in vacuum. J.Phys. Chem. B. 2005; 109: 4796–4800.
CHEN H, SHAO L, LIA Q, WANG J. Gold nanorods and their plasmonic properties. Chem. Soc. Rev., 2013,42, 2679-85.
CHEN J. and IRUDAYARAJ J. Quantitative Investigation of Compartmentalized Dynamics of ErbB2 Targeting Gold Nanorods in Live Cells by Single Molecule Spectroscopy. ACS Nano. 2009 Nov; 3(12): 4071–4079.
CHO SH. Estimation of tumor dose enhancement due to gold nanoparticles during typical radiation treatments: a preliminary Monte Carlo study. Phys Med Biol. 2005; 50:163–173.
CHO SH and La KS. The dosimetric feasibility of gold nanoparticle-aided radiation therapy (GNRT) via brachytherapy using low-energy gamma-/x-ray sources. Phys Med Biol 2009;54:4889-4905.
HAINFELD J.F. et al. Radiotherapy enhancement with gold nanoparticles. JPP 2008 Mar; 60: 977–985
JAIN S. et al. Cell-specific radiosensitization by gold nanoparticles at megavoltage radiation energies. Int J Radiat Oncol Biol Phys. 2011;79:531–9.
JAN SCHUEMANN. et al. Roadmap to Clinical Use of Gold Nanoparticles for Radiation Sensitization. Int J Radiation Oncol Biol Phys. 2016; 94 (1): 189-205.
KIRKBY C. and GHASRODDASHTI E. Targeting mitochondria in cancer cells using gold nanoparticle-enhanced radiotherapy: A Monte Carlo study. Med. Phys. 2015 Feb; 42 (2): 1119-1128.
LECHTMAN E, Implications on clinical scenario of gold nanoparticle radiosensitization in regards to photon energy, nanoparticle size, concentration and location. Phys. Med. Biol. 2011 jul; 56: 4631–4647.
LIN Y. et al. Comparing gold nano-particle enhanced radiotherapy with protons, megavoltage photons and kilovoltage photons: a Monte Carlo simulation Phys. Med. Biol. 2014 Nov; 59: 7675–7689.
McMAHON S.J. et al. Nanodosimetric effects of gold nanoparticles in megavoltage radiation therapy. Radiotherapy and Oncology. 2011 Jul; 100: 412–416.
MESBAHI A. A review on gold nanoparticles radiosensitization effect in radiation therapy of cancer. Reports of Practical Oncology and Radiotherapy. Vol.,15 : 176-178 (2010).
MESBAHI A. et al. Effect of Photon Beam Energy, Gold Nanoparticle Size and Concentration on the Dose Enhancement in Radiation Therapy. Bioimpacts. 2013 Dec; 3(1): 29–35.
NGWA W. et al. Applying gold nanoparticles as tumor-vascular disrupting agents during brachytherapy: estimation of endothelial dose enhancement. Phys. Med. Biol. 2010 Oct; 55: 6533–6548.
NGWA W. at al. Gold nanoparticle-aided brachytherapy with vascular dose painting: Estimation of dose enhancement to the tumor endothelial cell nucleus. Med. Phys. 2012 Jan; 39 (1): 392-398.
SINHA N. et al. Brachytherapy Application With In Situ Dose Painting Administered by Gold Nanoparticle Eluters. Int J Radiation Oncol Biol Phys. 2015; 91 (2): 385-392.
VERSIANI AF, ANDRADE LM, MARTINS EMN et al. Gold nanoparticles & their applications in biomedicine. Future Virol (2016).
XIAO M. et al. Gold nanotags for combined multi-colored Raman spectroscopy and x-ray computed tomography. Nanotechnology 21 (2010) 035101 (8pp).
ZHENG, I. et al. Radiosensitization of DNA by Gold Nanoparticles Irradiated with High-Energy Electrons. Radiation Research, 2008; 169(1):19-2